Câu hỏi mở đầu
42
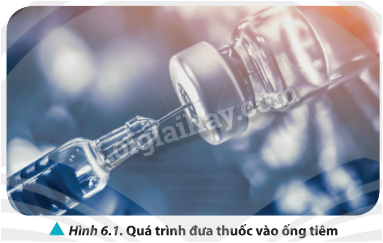
Để đưa thuốc từ lọ vào trong xilanh của ống tiêm, ban đầu nhân viên y tế đẩy pit- tông sát đầu trên của xilanh, sau đó đưa đầu kim tiêm (được gắn với ống tiêm) vào trong lọ thuốc. Khi kéo pit-tông, thuốc sẽ chảy vào trong xilanh (Hình 6.1). Quá trình lấy máu dùng trong xét nghiệm tại các cơ sở y tế cũng hoàn toàn tương tự. Ứng dụng trên dựa vào các định luật của chất khí. Vậy, đó là những định luật nào?
Gợi ý
Dựa vào các định luật của chất khí
Đáp án
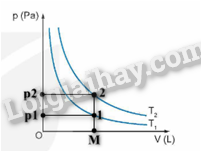
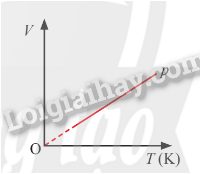
Ứng dụng trên dựa vào các định luật Boyle và Charles