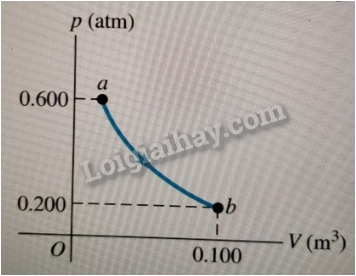
1. Lập phương trình chứng tỏ quá trình chuyển trạng thái không phụ thuộc cách chuyển trạng thái:
- Cách biến đổi trạng thái khác trong Hình 11.1:
+ Chọn trạng thái trung gian (1') với áp suất p' và thể tích V₂.
+ Áp dụng định luật Boyle cho quá trình đẳng nhiệt (1) → (1'): p₁V₁ = p'V₂
+ Áp dụng định luật Charles cho quá trình đẳng áp (1') → (2): V₂/T₁ = V₂/T₂
Thay V₂ từ hai phương trình trên vào nhau:\(\Rightarrow \frac{p_{1} V_{1}}{p^{\prime}}=\frac{V_{2}}{T_{2}} \Rightarrow p_{1} T_{1}=p^{\prime} T_{2}=\) const
So sánh với phương trình (11.1):
\[\frac{p_{1} T_{1}}{p_{2} T_{2}}=\text { const }\]Ta thấy hai phương trình có dạng tương tự nhau, chỉ khác nhau ở ký hiệu áp suất ( \(\mathrm{p}^{\prime}\) thay cho \(\mathrm{p}_{2}\) ).
2. Lý do không gọi phương trình (11.1) là phương trình trạng thái của chất khí:
- Phương trình (11.1): \(\frac{p_{1} T_{1}}{p_{2} T_{2}}=\) const
- Lý do không gọi phương trình (11.1) là phương trình trạng thái của chất khí:
+ Phương trình (11.1) chỉ áp dụng cho khí lí tưởng.
+ Khí lí tưởng là khí giả định, có các tính chất: Các phân tử khí có kích thước bằng 0 . Lực tương tác giữa các phân tử khí bằng 0 . Các phân tử khí chuyển động hỗn loạn, va chạm hoàn toàn đàn hồi.
+ Trên thực tế, không có khí nào hoàn toàn là khí lí tưởng.
+ Các khí thực đều có: Kích thước phân tử. Lực tương tác giữa các phân tử.
Do đó, phương trình (11.1) chỉ là phương trình trạng thái gần đúng của chất khí.