Mở đầu
48
Muối có rất nhiều ứng dụng trong đời sống như làm phân bón, bảo quản thực phẩm, làm bột nở cho các loại bánh, gia vị,… Muối có những tính chất hoá học nào và được điều chế như thế nào?
Đáp án
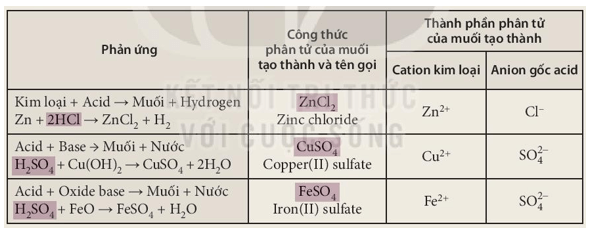
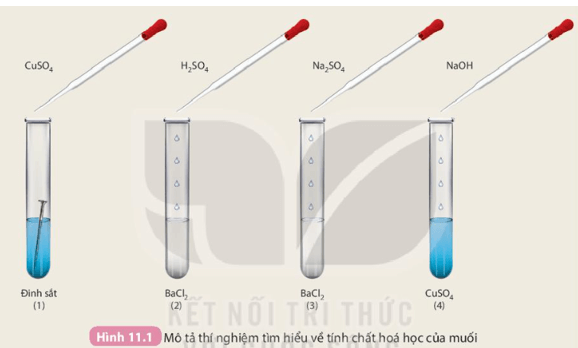
- Một số tính chất hoá học của muối:
+ Dung dịch muối tác dụng với kim loại;
+ Muối tác dụng với dung dịch acid;
+ Dung dịch muối tác dụng với dung dịch base;
+ Dung dịch muối tác dụng với dung dịch muối.
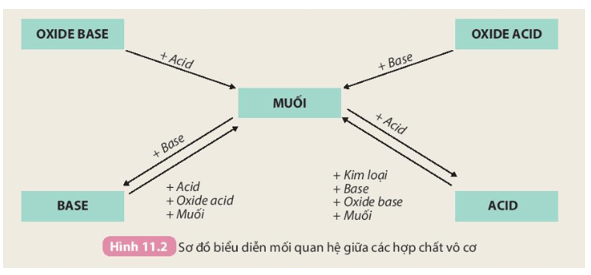
- Muối có thể được điều chế bằng một số phương pháp như:
+ Dung dịch acid tác dụng với base;
+ Dung dịch acid tác dụng với oxide base;
+ Dung dịch acid tác dụng với muối;
+ Oxide acid tác dụng với dung dịch base;
+ Dung dịch muối tác dụng với dung dịch muối.