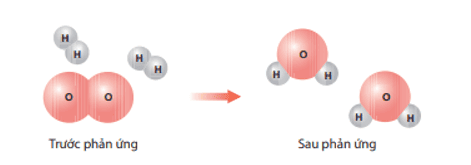
a) Lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
\(\mathrm{KClO}_3---\stackrel{\mathrm{MnO}_2}{\longrightarrow} \mathrm{KCl}+\mathrm{O}_2\)
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố:
+ Ta làm chẵn số nguyên tử \(\mathrm{O}\) ở vế trái bằng cách thêm hệ số 2 trước \(\mathrm{KClO}_3\) :
\(2 \mathrm{KClO}_3--\stackrel{\mathrm{MnO}_2}{\longrightarrow} \mathrm{KCl}+\mathrm{O}_2\)
+ Để số nguyên tử \(\mathrm{O}\) vế phải bằng với vế trái ta thêm hệ số 3 trước \(\mathrm{O}_2\) :
\(2 \mathrm{KClO}_3--\stackrel{\mathrm{MnO}_2}{\longrightarrow} \mathrm{KCl}+3 \mathrm{O}_2\)
+ Để số nguyên tử \(\mathrm{K}\) và số nguyên tử \(\mathrm{Cl}\) ở 2 vế bằng nhau ta thêm hệ số 2 trước \(\mathrm{KCl}\) :
\(2 \mathrm{KClO}_3---\stackrel{\mathrm{MnO}_2}{\longrightarrow} 2 \mathrm{KCl}+3 \mathrm{O}_2\)
Bước 3: Phương trình hoá học hoàn chỉnh:
\(2 \mathrm{KClO}_3---\stackrel{\mathrm{MnO}_2}{\longrightarrow} 2 \mathrm{KCl}+3 \mathrm{O}_2\)
b) Phương trình hoá học: \(2 \mathrm{KClO}_3---\stackrel{\mathrm{MnO}_2}{\longrightarrow} 2 \mathrm{KCl}+3 \mathrm{O}_2\)
Tỉ lệ các chất:
2 :2: 3
Số mol \(\mathrm{KClO}_3\) đem nung là:
\(n_{\mathrm{KClO}_3}=\frac{m_{\mathrm{KCOO}_3}}{M_{\mathrm{KClO}_3}}=\frac{4,9}{122,5}=0,04(\mathrm{~mol})\)
Theo tỉ lệ trong phương trình hoá học ta có:
\(\mathrm{n}_{\mathrm{KCl} \text { ly thuyết }}=n_{\mathrm{KClO}_3}=0,04(\mathrm{~mol}) ; \\\)
\(\Rightarrow \mathrm{m}_{\mathrm{KCl}} \text { ly thuyết }=0,04 \times 74,5=2,98(\mathrm{gam}) .\)
Có khối lượng KCI lý thuyết lớn hơn khối lượng KCl thu được thực tế nên phản ứng xảy ra không hoàn toàn. Hiệu suất của phản ứng là:
\(H(\%)=\frac{2,5}{2,98} \times 100(\%)=83,89(\%) .\)