Mở đầu
27
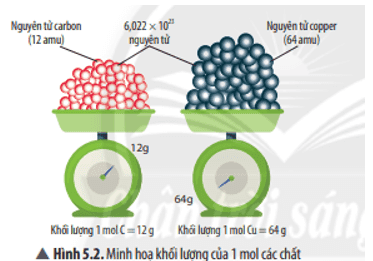
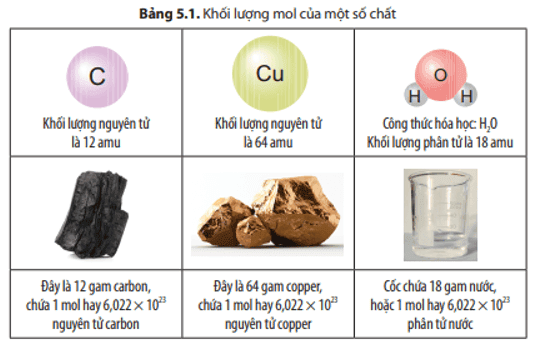
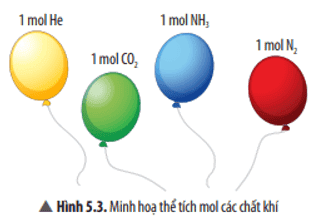
Các hạt (nguyên tử, phân tử) có kích thước và khối lượng vô cùng nhỏ bé, không thể xác định được bằng các dụng cụ đo thường dùng. Làm thế nào để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) của các chất?

Đáp án
Để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) của các chất ta dùng các khái niệm mol, khối lượng mol, thể tích mol chất khí