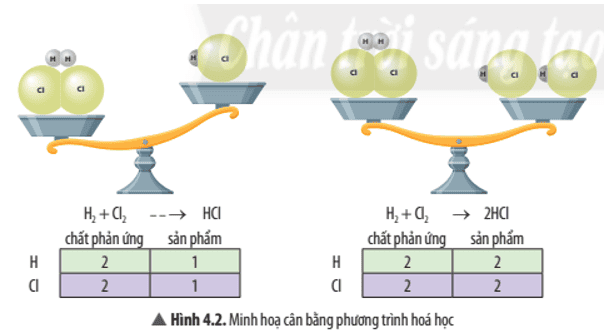
a) Bước 1: Viết sơ đồ phản ứng:
\(\mathrm{Na}+\mathrm{O}_2 \rightarrow \mathrm{Na}_2 \mathrm{O}\)
Bước 2: Làm chẵn số nguyên tử \(\mathrm{O}\) vế phải bằng cách đặt hệ số 2 trước \(\mathrm{Na}_2 \mathrm{O}\).
\(\mathrm{Na}+\mathrm{O}_2 \rightarrow 2 \mathrm{Na}_2 \mathrm{O}\)
Số nguyên tử Na vế trái và phải chưa bằng nhau, ta đặt hệ số 4 trước Na.
\(4 \mathrm{Na}+\mathrm{O}_2 \rightarrow 2 \mathrm{Na}_2 \mathrm{O}\)
Bước 3: Viết phương trình hoá học hoàn chỉnh:
\(4 \mathrm{Na}+\mathrm{O}_2 \rightarrow 2 \mathrm{Na}_2 \mathrm{O}\)
Tỉ lệ: 4 nguyên tử \(\mathrm{Na}: 1\) phân tử \(\mathrm{O}_2: 2\) phân tử \(\mathrm{Na}_2 \mathrm{O}\).
Hay cứ 4 nguyên tử Na tác dụng với 1 phân tử \(\mathrm{O}_2\) tạo ra 2 phân tử \(\mathrm{Na}_2 \mathrm{O}\).
b) Bước 1: Viết sơ đồ phản ứng
\(\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow \mathrm{NaOH}+\mathrm{BaCO}_3\)
Bước 2: Số nhóm \((\mathrm{OH})\) ở vế phải và vế trái chưa bằng nhau, ta đặt hệ số 2 trước \(\mathrm{NaOH}\).
\(\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow 2 \mathrm{NaOH}+\mathrm{BaCO}_3\)
Bước 3: Viết phương trình hoá học hoàn chỉnh:
\(\mathrm{Na}_2 \mathrm{CO}_3+\mathrm{Ba}(\mathrm{OH})_2 \rightarrow 2 \mathrm{NaOH}+\mathrm{BaCO}_3\)
Tỉ lệ: 1 phân tử \(\mathrm{Na}_2 \mathrm{CO}_3: 1\) phân tử \(\mathrm{Ba}(\mathrm{OH})_2: 2\) phân tử \(\mathrm{NaOH}: 1\) phân tử \(\mathrm{BaCO}_3\).
Hay cứ 1 phân tử \(\mathrm{Na}_2 \mathrm{CO}_3\) tác dụng với 1 phân tử \(\mathrm{Ba}(\mathrm{OH})_2\) tạo ra 2 phân tử \(\mathrm{NaOH}\) và 1 phân tử \(\mathrm{BaCO}_3\).
c) Bước 1: Viết sơ đồ phản ứng:
\(\mathrm{Fe}+\mathrm{O}_2 \rightarrow \mathrm{Fe}_3 \mathrm{O}_4\)
Bước 2: Số nguyên tử \(\mathrm{O}\) ở vế phải và vế trái chưa bằng nhau, ta thêm hệ số 2 vào \(\mathrm{O}_2\) :
\(\mathrm{Fe}+2 \mathrm{O}_2 \rightarrow \mathrm{Fe}_3 \mathrm{O}_4\)
Số nguyên tử Fe ở vế trái và vế phải chưa bằng nhau, ta thêm hệ số 3 vào Fe:
\(3 \mathrm{Fe}+2 \mathrm{O}_2 \rightarrow \mathrm{Fe}_3 \mathrm{O}_4\)
Bước 3: Viết phương trình hoá học hoàn chỉnh:
\(3 \mathrm{Fe}+2 \mathrm{O}_2 \rightarrow \mathrm{Fe}_3 \mathrm{O}_4\)
Tỉ lệ: 3 nguyên tử \(\mathrm{Fe}: 2\) phân tử \(\mathrm{O}_2: 1\) phân tử \(\mathrm{Fe}_3 \mathrm{O}_4\).
Hay cứ 3 nguyên tử Fe tác dụng với 2 phân tử \(\mathrm{O}_2\) được 1 phân tử \(\mathrm{Fe}_3 \mathrm{O}_4\).