Mở đầu
62
Thạch nhũ trong các hang động có thành phần chính là muối của calcium, nước biển chứa muối ăn và nhiều loại muối khác. Trong tự nhiên, các kim loại thường tồn tại dưới dạng muối. Muối là gì? Muối có thành phần tính chất và mối quan hệ với acid, base, oxide như thế nào?

Đáp án
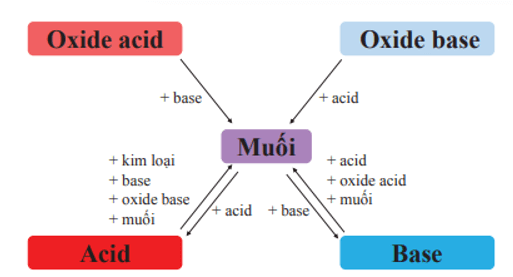
Muối là hợp chất được tạo ra khi thay thế ion \(\mathrm{H}^{+}\) trong acid bằng ion kim loại hoặc ion ammonium (\(\mathrm{NH_4}^{+}\)).
Thành phần của muối: ion kim loại (hoặc ion ammonium) và ion gốc acid.
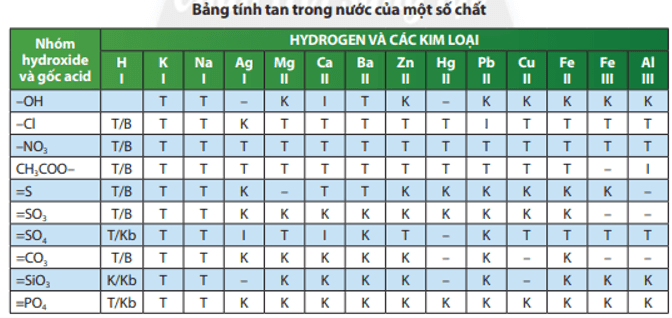
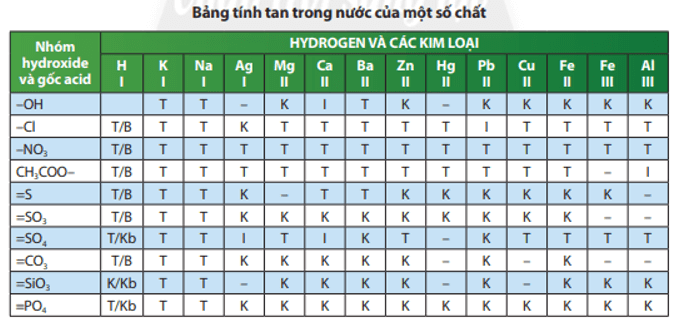
Muối có thể tan, không tan hoặc ít tan trong nước.
Tính chất hoá học của muối:
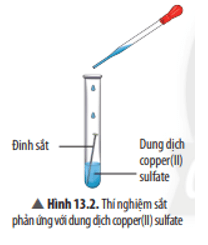
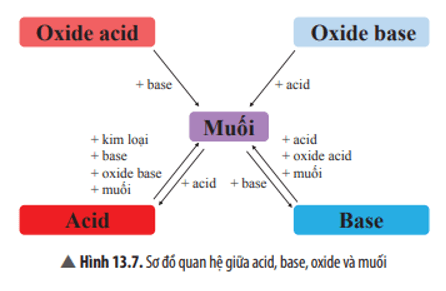
+ Dung dịch muối phản ứng với kim loại tạo thành muối mới và kim loại mới.
+ Dung dịch muối phản ứng với dung dịch base tạo thành muối mới và base mới.
+ Dung dịch muối phản ứng với dung dịch acid tạo thành muối mới và acid mới.
+ Hai dung dịch muối phản ứng với nhau tạo thành hai muối mới.
Mối quan hệ giữa acid, base, oxide và muối được thể hiện bằng sơ đồ: