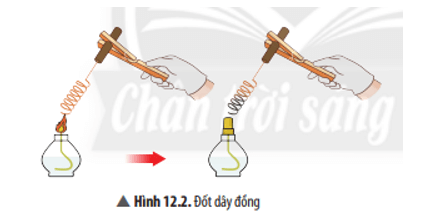
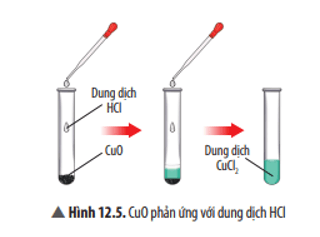
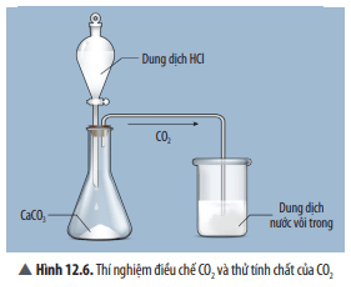
Mở đầu
56
Một số oxide phổ biến tạo nên các khoáng chất như đá granite và thạch anh (oxide của silicon), gỉ sắt (oxide của sắt) và đá vôi (oxide của calcium và carbon). Đá ruby tự nhiên có dải màu từ hồng đậm đến đỏ sẫm do thành phần các oxide của alumium, chromium, … tạo nên. Oxide là gì? Có những loại oxide nào? Chúng có sẵn trong tự nhiên hay phải điều chế?

Đáp án
- Oxide là hợp chất gồm hai nguyên tố, trong đó có nguyên tố oxygen.
- Có 4 loại oxide:
+ Oxide acid là oxide phản ứng được với dung dịch base tạo thành muối và nước.
+ Oxide base là oxide phản ứng được với dung dịch acid tạo thành muối và nước.
+ Oxide lưỡng tính là oxide vừa phản ứng được với dung dịch acid, vừa phản ứng với dung dịch base.
+ Oxide trung tính là các oxide không phản ứng với dung dịch acid, không phản ứng với dung dịch base.
- Có những oxide có sẵn trong tự nhiên, có những oxide không có sẵn trong tự nhiên con người điều chế ra.