Mở đầu
85
Thiết bị, vật dụng, công trình làm bằng kim loại thường bị hư hỏng sau một thời gian do sự ăn mòn kim loại.Tuy nhiên, nếu hiểu rõ nguyên nhân của quá trình ăn mòn kim loại, con người có thể giảm thiểu tác động của quá trình ăn mòn. Ăn mòn kim loại là gì? Làm thế nào để chống ăn mòn kim loại?
Gợi ý
Nêu khái niệm ăn mòn kim loại, cách phòng chống ăn mòn kim loại.
Đáp án
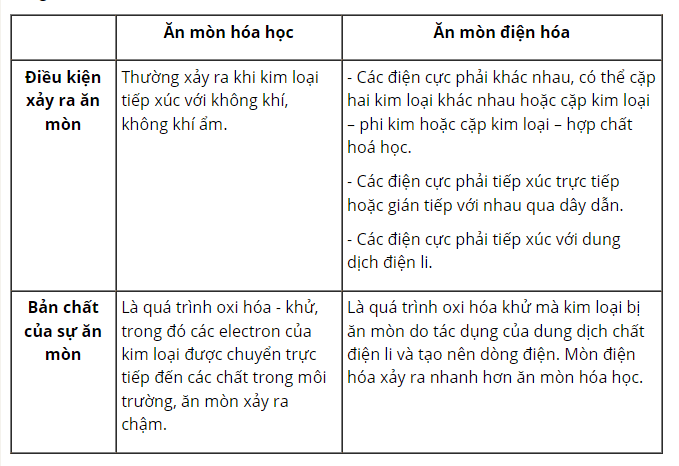
- Sự ăn mòn kim loại là sự phá huỷ kim loại hoặc hợp kim do tác dụng của các chất trong môi trường. Có hai loại ăn mòn chính: ăn mòn hoá học và ăn mòn điện hoá.
- Có hai phương pháp thường dùng để chống ăn mòn kim loại: phương pháp bảo vệ bề mặt và phương pháp điện hoá.