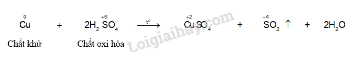Mở đầu
75
Kim loại giữ vai trò quan trọng trong các ngành kĩ thuật vì chúng có những tính chất vật lí, hoá học đặc biệt. Kim loại có cấu tạo nguyên tử như thế nào? Có những tính chất và ứng dụng gì?
Gợi ý
Nêu cấu tạo nguyên tử, tính chất và ứng dụng của kim loại.
Đáp án
- Cấu tạo nguyên tử: Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim. Đa số các nguyên tử kim loại có số electron ở lớp ngoài cùng là 1,2, 3.
- Tính chất:
+ Tính chất vật lí chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và tính dẻo.
+ Tính chất hóa học:
· Kim loại tác dụng với phi kim.
· Kim loại tác dụng với dung dịch acid.
· Kim loại tác dụng với nước.
· Kim loại tác dụng với dung dịch muối.
- Ứng dụng: một số kim loại được dùng làm đồ trang sức hay làm các vật dụng trang trí; kim loại có tính dẫn điện tốt được dùng làm dây dẫn điện như Cu, Al; kim loại có tính dẫn nhiệt tốt có thể được dùng làm dụng cụ đun nấu…