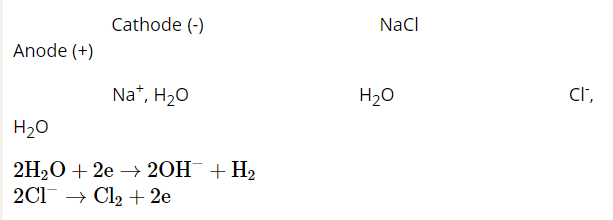Mở đầu
70
Pin điện hoá hoạt động dựa trên các phản ứng oxi hoá - khử tự xảy ra trong pin (hoá năng chuyển thành điện năng). Tuy nhiên, một số phản ứng oxi hoá - khử chỉ có thể xảy ra nhờ năng lượng dòng điện, được gọi là phản ứng điện phân (điện năng chuyển thành hoá năng).
Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất?
Gợi ý
Nêu nguyên tắc, ứng dụng của điện phân.
Đáp án
- Nguyên tắc điện phân:
+ Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
+ Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
- Ứng dụng: điều chế, tinh chế một số kim loại, mạ điện,...