Mở đầu
64
Người ta dùng hai sợi dây làm bằng hai kim loại khác nhau cắm vào một quả chanh và nối với một bóng đèn 3 V thì thấy bóng đèn sáng. Như vậy, quả chanh có cắm hai sợi dây kim loại khác nhau đóng vai trò như một viên pin, phát sinh ra dòng điện.
Cấu tạo và nguyên tắc hoạt động của pin như thế nào?
Gợi ý
Nêu cấu tạo và nguyên tắc hoạt động của pin.
Đáp án
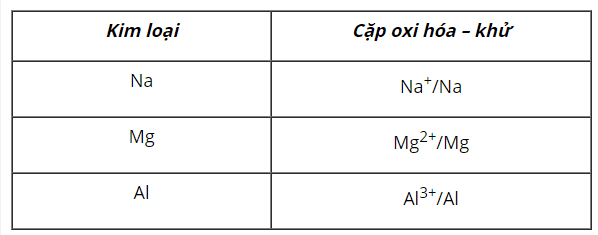
- Cấu tạo: Pin Galvani gồm 2 điện cực có thế điện cực khác nhau, thường được ghép với nhau qua cầu muối.
- Nguyên tắc hoạt động: Pin Galvani chuyển năng lượng của phản ứng hoá học thành năng lượng điện.