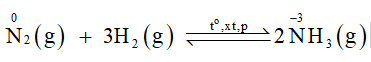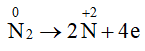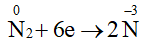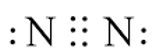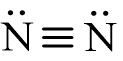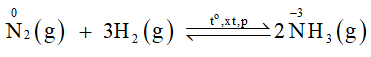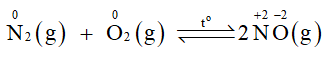Mở đầu
29
Trong công nghiệp, đơn chất nitrogen kết hợp với hydrogen tạo thành ammonia là một hợp chất quan trọng trong sản xuất phân bón, hoá chất.
Tại sao phản ứng trên cần được thực hiện ở nhiệt độ cao? Đơn chất nitrogen đóng vai trò gì trong phản ứng đó?
Đáp án
- Phản ứng giữa nitrogen và hydrogen cần được thực hiện ở nhiệt độ cao do liên kết ba giữa 2 nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/ mol) nên khó bị phá vỡ.
- Phương trình hoá học:
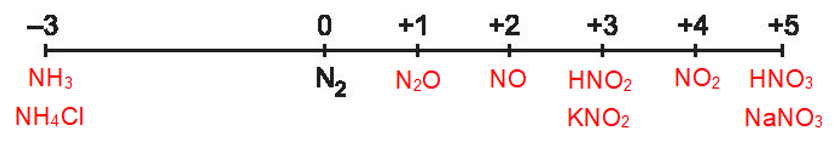
Số oxi hoá của nitrogen giảm từ 0 xuống -3 nên trong phản ứng này đơn chất nitrogen đóng vai trò là chất oxi hoá.