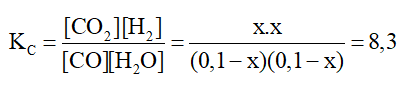Nồng độ ban đầu của khí CO là:
Nồng độ ban đầu của hơi nước \(\mathrm{H}_2 \mathrm{O}\) là:
\(\mathrm{CO}(g)+\mathrm{H}_2 \mathrm{O}(g) \rightleftharpoons \mathrm{CO}_2(g)+\mathrm{H}_2(g)\)
Ban đầu: 0,1 0,1 0 0 M
Phản ứng: x x x x M
Cân bằng: (0,1 – x) (0,1 – x) x x M
Áp dụng công thức:
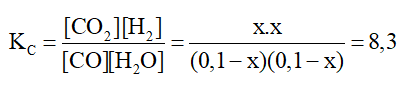
⇒ \(\Rightarrow \mathrm{x}^2=8,3\left(\mathrm{x}^2-0,2 \mathrm{x}+0,01\right)\)
⇔ \(\Leftrightarrow 7,3 \mathrm{x}^2-1,66 \mathrm{x}+0,083=0\)
⇒ x = 0,074 (thoả mãn); x = 0,153 (loại do > 0,1).
Vậy ở trạng thái cân bằng:
\(\mathrm{[CO_2]}=\mathrm{H}_2]=0,074 \mathrm{M}\)
\(\mathrm{[CO]}=\mathrm{[H_2O]=0,026 \mathrm{M} .}\)

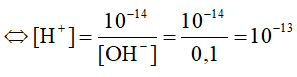
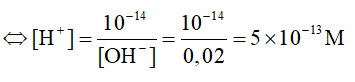
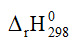 = -9,6 kJ
= -9,6 kJ