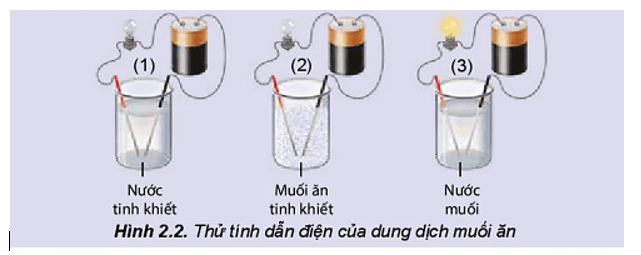
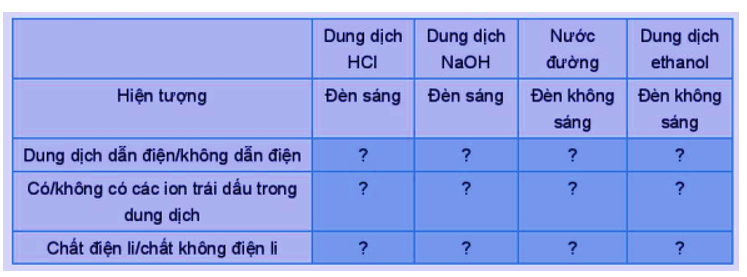
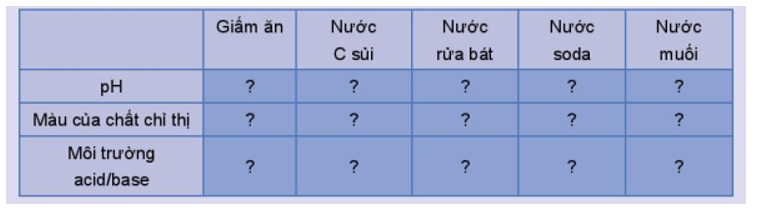
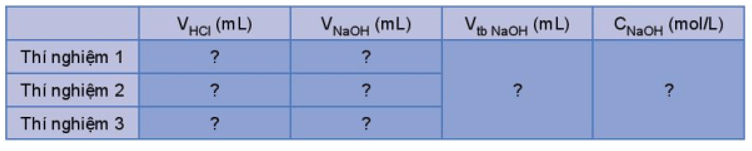
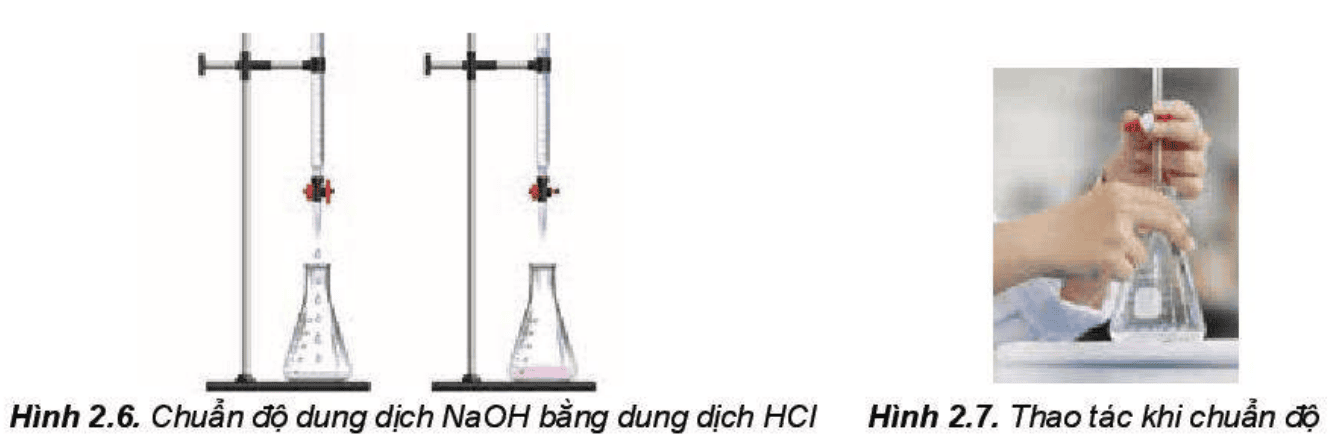
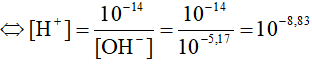Mở đầu
16
Hình 2.1 cho thấy giá trị pH của dung dịch một số chất thông dụng. Vậy pH là gì? pH có ảnh hưởng gì đến đời sống? Xác định pH như thế nào?

Đáp án
- pH là một đại lượng liên hệ trực tiếp với nồng độ \(\mathrm{H}^{+}\) để đánh giá tính acid, base của một dung dịch đã cho, với quy ước như sau:
\(\mathrm{pH}=-\log \left[\mathrm{H}^{+}\right]\) hoặc \(\left[\mathrm{H}^{+}\right]=10^{-\mathrm{pH}}\)
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động, thực vật, …
Ví dụ:
+ Cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
+ Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp.