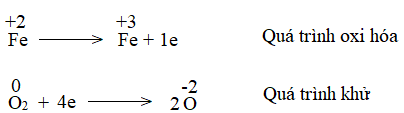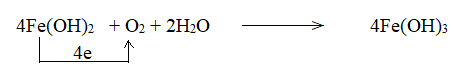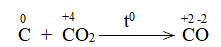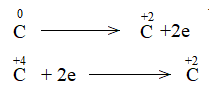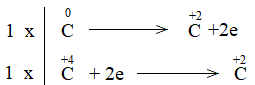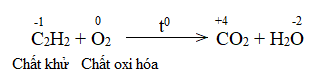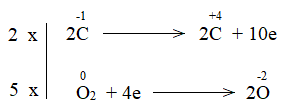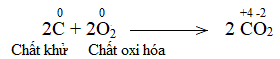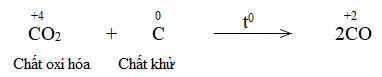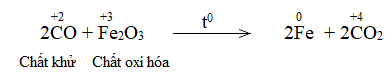Mở đầu
71
Trong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ:
\(Fe_2O_3 + CO \xrightarrow{{{t^o}C}} Fe + CO_2\)
Về bản chất, phản ứng oxi hóa - khử là gì, dựa vào dấu hiệu nào để nhận ra loại phản ứng đó?
Làm thế nào để lập phương trình hóa học của phản ứng trên?
Gợi ý
- Phản ứng oxi hóa – khử xảy ra đồng thời quá trình nhường và nhận.
- Trong phản ứng oxi hóa khử, có sự thay đổi số oxi hóa.
- Nguyên tắc lập phương trình hóa học của phản ứng oxi hóa – khử là tổng số electron nhường bằng tổng số electron nhận.
Đáp án
- Về bản chất, phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu để nhận ra loại phản ứng oxi hóa – khử là có sự thay đổi số oxi của các nguyên tử.
- Các bước lập phương trình hóa học của phản ứng oxi hóa – khử:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử
Nguyên tử Fe và C có sự thay đổi số oxi hóa, Fe là chất oxi hóa, C là chất khử
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử
\(Fe^{+3} + 3e → FeO\)
\(C^{+2} → C^{+4} + 2e\)
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc tổng electron nhường bằng tổng electron nhận.
\(2\times |Fe^{+3} + 3e → FeO\)
\(3\times |C^{+2} → C^{+4} + 2e\)
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng.
\(Fe_2O_3+ 3CO \xrightarrow{{{t^o}C}} 2Fe + 3CO-2\)