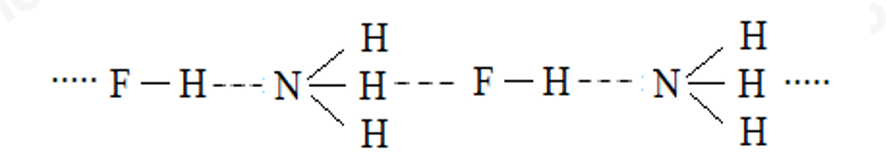Mở đầu
64
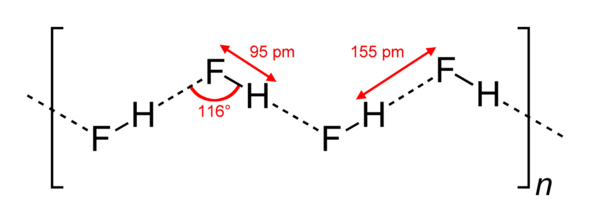
Ở áp suất khí quyển, nhiệt độ sôi của \(H_2O \) là 1000C, CH4 là -161,58\(^0C\), \(H_2S \) là -60,28\(^0C\). Vì sao các chất trên có nhiệt độ sôi khác nhau.
Gợi ý
Liên kết hydrogen làm tăng nhiệt độ sôi của nước so với \(H_2S \) và \(CH_4\).
Đáp án
- Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
- Do O và S đều còn 2 cặp electron hóa trị chưa tham gia liên kết, C không còn cặp electron hóa trị tự do nên \(H_2O \) và \(H_2S \) có thể tạo liên kết hydrogen trong phân tử, còn CH4 thì không.
=> Nhiệt độ sôi của \(H_2O \) và \(H_2S\) lớn hơn \(CH_4\).
- Do độ âm điện của O lớn hơn S nên liên kết hydrogen trong phân tử \(H_2O \) mạnh hơn trong phân tử \(H_2S\).
=> Nhiệt độ sôi của \(H_2O\) lớn hơn \(H_2S\).