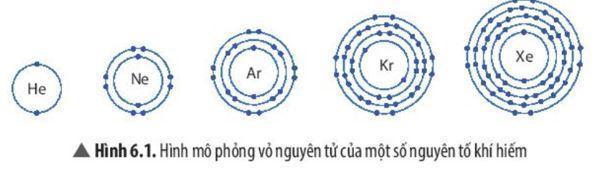
a) Na và S
Na là nguyên tố kim loại, S là nguyên tố phi kim nên liên kết tạo thành giữa Na và S là liên kết ion.
Nguyên tử kim loại Na có 1 electron lớp ngoài cùng, để đạt được 8 electron lớp ngoài cùng giống khí hiếm Ne gần nó thì nguyên tử Na nhường 1 electron.
Nguyên tử S có 6 electron lớp ngoài cùng, cần nhận thêm 2 electron để đạt được 8 electron lớp ngoài cùng giống Ar.
→ 2 nguyên tử Na liên kết ion với 1 nguyên tử S.
→ Tỉ lệ: 2Na: 1S
b) H và Cl
H và Cl là nguyên tố phi kim nên liên kết tạo thành giữa H và Cl là liên kết cộng hóa trị.
Mỗi nguyên tử hydrogen có 1 electron, để đạt được lớp electron ngoài cùng bền vững của khí hiếm gần hydrogen là khí helium có 2 electron, nguyên tử hydrogen cần thêm 1 electron và góp chung 1 electron của mình để tạo liên kết cộng hóa trị.
Nguyên tử chlorine có 7 electron lớp ngoài cùng, cần thêm 1 electron để có 8 electron lớp ngoài, nguyên tử chlorine góp chung 1 electron của mình để tạo liên kết cộng hóa trị với một nguyên tử hydrogen.
→ Tỉ lệ: 1H : 1Cl
c) N và H
N và H là nguyên tố phi kim nên liên kết tạo thành giữa N và H là liên kết cộng hóa trị.
Mỗi nguyên tử hydrogen có 1 electron, để đạt được lớp electron ngoài cùng bền vững của khí hiếm gần hydrogen là khí helium có 2 electron, nguyên tử hydrogen cần thêm 1 electron và góp chung 1 electron của mình để tạo liên kết cộng hóa trị.
Nguyên tử nitrogen có 5 electron lớp ngoài cùng, cần thêm 3 electron để có 8 electron lớp ngoài, nguyên tử nitrogen góp chung 3 electron của mình để tạo liên kết cộng hóa trị với ba nguyên tử hydrogen.
→ Tỉ lệ: 1N : 3H
d) Ca và O
Ca là nguyên tố kim loại, O là nguyên tố phi kim nên liên kết tạo thành giữa Ca và O là liên kết ion.
Nguyên tử kim loại Ca có 2 electron lớp ngoài cùng, để đạt được 8 electron lớp ngoài cùng giống khí hiếm Ar gần nó thì nguyên tử Ca nhường 2 electron.
Nguyên tử O có 6 electron lớp ngoài cùng, cần nhận thêm 2 electron để đạt được 8 electron lớp ngoài cùng giống Neon.
→ 1 nguyên tử Ca liên kết ion với 1 nguyên tử O.
→ Tỉ lệ: 1Ca : 1O
e) K và Cl
K là nguyên tố kim loại, Cl là nguyên tố phi kim nên liên kết tạo thành giữa K và Cl là liên kết ion.
Nguyên tử kim loại K có 1 electron lớp ngoài cùng, để đạt được 8 electron lớp ngoài cùng giống khí hiếm Ar gần nó thì nguyên tử K nhường 1 electron.
Nguyên tử Cl có 6 electron lớp ngoài cùng, cần nhận thêm 1 electron để đạt được 8 electron lớp ngoài cùng giống Ar.
→ 1 nguyên tử K liên kết ion với 1 nguyên tử Cl.
→ Tỉ lệ: 1K : 1Cl